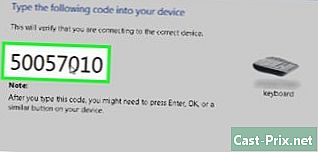
Kuinka nimetä ionisia yhdisteitä
Kirjoittaja:
Roger Morrison
Luomispäivä:
5 Syyskuu 2021
Päivityspäivä:
1 Heinäkuu 2024

Sisältö
- vaiheet
- Menetelmä 1 Nimeä binaariset ioniset yhdisteet
- Menetelmä 2 Nimeä yhdisteet, jotka sisältävät siirtymämetalleja
- Menetelmä 3 Nimeä yhdisteet, jotka sisältävät polyatomisen ionin
Ioniyhdisteet koostuvat positiivisista metalli-ioneista (kationit) ja negatiivisista ionittomista dioneista (anioneista). Ioniyhdisteen nimen löytämiseksi sinun on ensin löydettävä ei-metallisen (oikeanpuoleinen elementti) nimi oikealla päätteellä (-ure, ate ...), sitten yhdistetyn metallin nimi (vasen elementti), mutta ilman pääte. Siirtymämetalleja sisältävien yhdisteiden osalta sääntö pysyy samana, kuitenkin muutamilla pienillä muunnelmilla.
vaiheet
Menetelmä 1 Nimeä binaariset ioniset yhdisteet
-

Katso elementtien jaksollinen taulukko. Kaikki tunnetut kemialliset elementit ovat jaksollisessa taulukossa. Binaarinen ioninen yhdiste on valmistettu metallista (kationista) ja ei-metallista (anionista). Tämä ei ole yleisyys, mutta elektronien (anionien) saamiseen kykenevät elementit ovat pikemminkin taulukon oikealla puolella, kationit, melko vasemmalla. Metallit ovat melko vasemmalla ja pöydän keskellä.- Anionit kuuluvat useimmiten jaksollisen ryhmän 15, 16 tai 17 ryhmiin. Eri elementtiperheet on merkitty legendassa selitetyillä väreillä.
- Jos sinulla ei ole tätä pöytää kädessä, löydät sen helposti Internetistä, esimerkiksi tältä sivustolta.
-

Kirjoita ionisen yhdisteen kaava tuntemattomalla nimellä. Oletetaan, että sinua pyydetään antamaan kaavan mukaisen ionisen yhdisteen nimi NaCl:. Käytössä olevista olosuhteista riippuen voit kirjoittaa sen kannettavaan tietokoneeseen tai taululle.- Tämä esimerkki tunnetaan hyvin, mutta sen avulla voidaan ymmärtää nimikkeistön periaate: NaCl: siinä on vain kaksi ionia eikä se sisällä siirtymämetalleja.
-

Kirjoita metallin nimi. Yhdisteen nimen toinen osa on itse asiassa metallin nimi, kaavassa ensin oleva elementti, positiivisesti varautunut elementti (kationi). Tätä metallia edeltää sana of (kloridi of natrium). Alkujaksollisen taulukon löydät, että symboli na on natrium, joten aseta toiseksi.- Sääntö on muuttumaton: metallin nimi on aina toisessa asennossa, kun taas sen symboli on kaavassa ensimmäinen.
-

kirjoita ei-metallin nimi jälkiliitteellä. Jos kyseessä on yksinkertainen anioni, sinun on lisättävä -ure elementin juuressa. Esimerkissämme meillä on lanioni clyhdiste on klooriurekoska cl on kloori. Joskus se on hieman monimutkaisempi: joten kun lazote on vaakalaudalla, emme puhu atsidista, vaan nitridistä.- Monien Danionien nimellisperiaate pysyy ennallaan. Joten kaikissa fosforia sisältävissä ionisissa yhdisteissä on fosfidi ... ja jos on diodi, a jodidi ...
-

Kokoa oikeassa järjestyksessä lanionin ja kationin nimet. Kun ionisen yhdisteen kahden osan nimet on löydetty, olet kauemmas tavoitteesta. Ne on koottava anionikationijärjestyksessä, johon NaCl: antaa natriumkloridi . -

Harjoittele muiden yksinkertaisten ioniyhdisteiden kanssa. Olemme juuri nähneet hyvin tunnetun tapauksen natriumkloridista, mutta on myös monia muita tämän tyyppisiä yhdisteitä. Jotkut on säilytettävä toimimaan malleina yhdisteille, joita kohdataan harvemmin. Näillä yhdisteillä ei tarvitse ottaa huomioon mukana olevien dionien lukumäärää. Yritä harjoituksina löytää seuraavien yhdisteiden nimet (vastaus on näkyvissä, jos valitset tyhjän tilan merkin "=" jälkeen):- li2S = litiumsulfidi
- Ag2S = hopeasulfidi
- MgCI2 = magnesiumkloridi
Menetelmä 2 Nimeä yhdisteet, jotka sisältävät siirtymämetalleja
-

Syötä ionisen yhdisteen kaava. Otetaan esimerkiksi esimerkki yhdisteestä, jolla on kaava: Fe2O3. Siirtymämetallit ovat jaksotaulukon keskiosassa ja neljältä riviltä löydät esimerkiksi platinaa, kultaa, zirkoniumia ... Yhdisteen nimen löytämiseksi sinun on otettava huomioon sen kuormitus, raportoitu roomalaisella numerolla.- Siirtymämetalliyhdisteet ovat aina hiukan herkempiä nimittää, koska viimeksi mainittujen hapettumisaste (varaus) voi vaihdella reaktiosta riippuen.
-

Määritä leijonan metallikuormitus. Jos pelissä oleva metalli kuuluu ainakin jaksotaulukon ryhmään 3, sinun on oltava huolissaan sen hapettumismäärästä. Lanionin lindice, johon metalli liittyy, osoittaa siirtymämetallin varauksen. Metallien varaus on positiivinen, ja tässä tapauksessa hapen varaus on aina -2, kolme atomia O3 Oletetaan, että tasapainossa on 6 elektronia. Koska sisällä on kaksi rautaatomia Fesiksi päätellään, että rautakuorma tässä on +3.- Voit myös tehdä päinvastaisen kirjoittamalla, että happileijonon varaus on -2.
- Yleensä kouluharjoituksissa molempien elementtien kuormat mainitaan joko kaavassa tai lauseessa.
-

Etsi metallin nimi. Lisäät hänen veloituksensa roomalaisin numeroin. Etsi tarvittaessa kationin nimi (metalli) jaksotaulusta. Fe on raudan symboli ja sillä on positiivinen varaus +3, joudut kirjoittamaan ... rauta (III) .- Roomalaisia numeroita käytetään vain yksikössä. Ne eivät missään tapauksessa näy kaavoissa tai reaktioissa.
-

Löydä ei-metallin oikea muotoilu. Jäljitys on löydettävä. Etsi tarvittaessa jaksotaulusta lanionin nimi. Näin happi (O) on erityistapaus: se menettää lopunsa -geenin puolesta -From, joka antaa oksidi .- Toisaalta kaikki muut anionit lopettavat toimintansa -ure. On selvää, että mitä metallia tahansa liittyy, anionit merkitään aina samalla tavalla.
-

Yhdistä kahden elementin nimet. Tämä toimenpide ei eroa siitä, mitä olemme nähneet yksinkertaisilla yhdisteillä. Kokoa kaksi aiemmin määriteltyä nimikkeistöelementtiä, puhumattakaan roomalaisesta numerosta. Näin Fe2O3 on kotoisinrautaoksidi (III) . -

Tunne vanhat nimitykset. Aikaisemmin roomalaisia numeroita ei käytetty siirtymämetalleihin, heillä oli -eux tai sisään -ique. Tarkkaile tarkasti ionisen yhdisteen kahta osaa. Jos metallileijonalla on pienempi lataus kuin ei-metallisella leijonalla, käytät loppua sisään -eux. Jos se on päinvastainen, käytät loppua -ique .- Fe: llä on pienempi varaus kuin hapolla (Fe: llä on suurempi varaus), joten rauta antaa tässä tavoitteen rauta-. Joten FeO on kotoisinrautaoksidi.
- Nimellisarvot rauta- ja rauta- siksi on sama juuri annettuna mitä molemmat viittaavat elementtiin Fe.
-

Älä käytä roomalaisia numeroita tiettyjen yhdisteiden kanssa. Tämä koskee niitä, jotka sisältävät sinkkiä tai hopeaa. Näillä kahdella metallilla on kemiallisesta reaktiosta riippumatta sama hapettumismäärä, niin että on vain yksi nimitys: sinkin varaus on aina +2, kun taas hopean varaus on aina +1.- Tämä tarkoittaa, että näitä alkuaineita sisältävät yhdisteet ovat aina tyyppiä "... sinkki" tai "... hopea". Et koskaan näe roomalaisia numeroita yhdessä.
Menetelmä 3 Nimeä yhdisteet, jotka sisältävät polyatomisen ionin
-

Syötä kaava polyatomiaionillesi. Määritelmänsä mukaan tällainen ioninen yhdiste sisältää useat ionit yhdistetään eri tavoin. Yleensä on yksi kationi (metalli) ja anioni (ei-metalli), jotka koostuvat useista atomista. Jos et tiedä ionien nimiä, katso jaksotaulukko. Otetaanpa klassinen esimerkki, kaavayhdiste FeNH4(SO4)2 . -

Määritä leijonan metallivaraus. Ensinnäkin leijona SO4 lataus on -2. 2 SO-hakemistossa4 osoittaa, että yhdisteessä on kaksi tällaista ionia. Tätä ionia kutsutaan sulfaattikoska se on hapen ja rikin yhdistelmä. Sen kuorma on siten: 2 x -2 = -4. Sen sijaan ammoniumleijona NH4 (jossa on 1 typpiatomi ja 4 vetyä) on varaus +1. Kaasua ammoniakki NH-kaava3 on vakaa ja siinä on neutraali varaus, mutta jos siihen lisätään vetyatomi, siitä tulee NH4 latauksella +1. Ammoniumsulfaatti (NH4(SO4)2 sen vuoksi kuorma on: -4 + 1 tai -3. Se tarkoittaa, että rautaleijona (Fe), että yhdisteellä on oltava vakaa +3 varausta.- Ioniyhdisteillä on neutraali varaus, muuten ne eivät olisi stabiileja. Tämän ominaisuuden ansiosta löydät metallileijonokuorman.
- Lion SO4 sen varaus on -2 ja kun se yhdistetään kahden vetyatomin kanssa, joista kummassakin on varaus -1, siitä tulee stabiilia yhdistettä: kaavan H mukainen rikkihappo2SO4 .
-

Nimeä metalli-ioni. Tähän on kaksi tapaa: vanha menetelmä ja uusi, vaikka se alkaisi olla vanhentunut. Fe: n tapauksessa2O3, voit sanoa, että se on rautaoksidi (vanha nimi) tai rautaoksidi (III) (uusi nimellisarvo). -

Syötä ei-metallisten ionien yleinen nimi. Lukemalla jaksotaulukon huomaat, että symboli S vastaa rikkiä ja yhdistetään hapen kanssa muodossa SO4hänestä tulee sulfaatti. Samoin, kun typpiatomi yhdistetään 4 vetyatomin kanssa (NH4), koko on ammoniumlioni. Lopuksi, yhdistämällä nämä kaksi, sinulla on ammoniumsulfaatti.- Kaasua ammoniakki, jolla on neutraali varaus, tulee ammoniumleijonaksi, jos siihen lisätään positiivinen ioni.
- Yhdistä metallin nimet epämetallien nimiin. Tämä on niin FeNH4(SO4)2 on kotoisin ammonium- ja rautasulfaatti (III).

- Entisella nimellä tätä yhdistettä kutsutaan rauta (ammonium) sulfaatti.