Kuinka nimetä kemialliset yhdisteet
Kirjoittaja:
Laura McKinney
Luomispäivä:
2 Huhtikuu 2021
Päivityspäivä:
26 Kesäkuu 2024

Sisältö
- vaiheet
- Menetelmä 1 Ioniyhdisteiden nimikkeistö
- Menetelmä 2 Polyatomisten yhdisteiden nimikkeistö
- Menetelmä 3 kovalenttisten yhdisteiden nimikkeistö
Kemian alan menestyminen edellyttää, että tunnet kemiallisten perusyhdisteiden nimeämisen. Tämä opas tarjoaa sinulle perussäännöt kemiallisten yhdisteiden nimeämisprosessista ja siitä, kuinka nimet antaa yhdisteille, jotka eivät ole sinulle tuttuja.
vaiheet
Menetelmä 1 Ioniyhdisteiden nimikkeistö
- Mikä on ioninen yhdiste? Ioniyhdisteet koostuvat metallista ja ei-metallista. Katso sitten jaksoittainen elementtitaulukko tietääksesi, mitkä kategoriat kuuluvat yhdisteessä oleviin elementteihin.
-

Muodosta nimi. Mikään ei ole helpompaa kuin nimetä kahden elementin ioninen yhdiste. Itse asiassa yhdisteen nimen ensimmäinen osa vastaa ei-metallisen elementin nimeä, jolla on jälkiliite "ure", kun taas toinen vastaa metallielementin nimeä. On poikkeuksia: oksidi, fosfidi, nitridi, sulfidi.- Esimerkki: Al2O3. ai2 = Alumiini; O3 = Happi. Joten yhdisteen nimi on "alumiinioksidi".
-
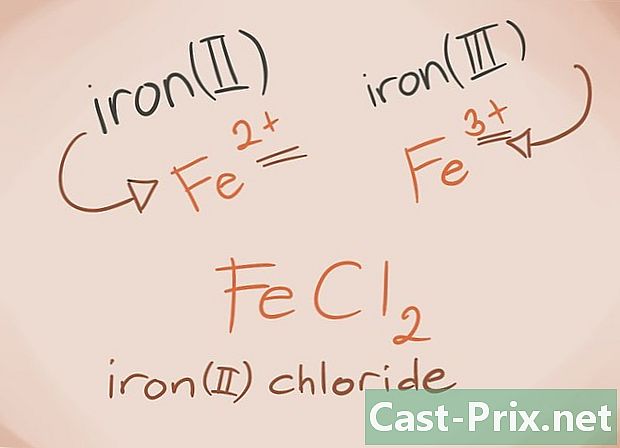
Tunne siirtymämetallit: Siirtymämetallit ovat niitä, jotka löytyvät jaksollisen taulukon D- ja F-lohkoista. Yhdisteen nimessä näiden metallien varaus on kirjoitettu roomalaisin numeroin. Tämä johtuu siitä, että siirtymämetallit voivat kantaa enemmän kuormaa ja muodostaa enemmän yhdistettä.- Esimerkki: FeCl2 ja FeCI3. Fe = rauta; cl2 = -2 kloridi; cl3 = Kloridi -3. Nimiä ovat rautakloridi (II) ja rautakloridi (III).
Menetelmä 2 Polyatomisten yhdisteiden nimikkeistö
-

Sinun on ymmärrettävä, mikä on polyatominen yhdiste. Polyatomiset yhdisteet ovat yhdisteitä, jotka muodostuu ryhmästä toisiinsa liittyviä datomeja; koko ryhmä, jolla on varaus, on positiivinen tai negatiivinen. Sitten on olemassa kolme perustoimintoa, joita voit käyttää polyatomisiin yhdisteisiin:- Voit lisätä vetyä yhdisteen ensimmäiseen osaan. Sana "vety" lisätään todellakin yhdisteen nimen alkuun. Tämä vähentää negatiivisen varauksen arvoa yhdellä. Esimerkiksi "karbonaatti" CO3 tulee "vetykarbonaatiksi" HCO3.

- Voit myös poistaa happea yhdisteestä. Kuormaa ei muuteta, mutta yhdisteen "-ate" -liite muutetaan "-ique" -ksi. Esimerkiksi muunnokset: EI3 EI2 siirrymme nitraatista nitraatiksi. "

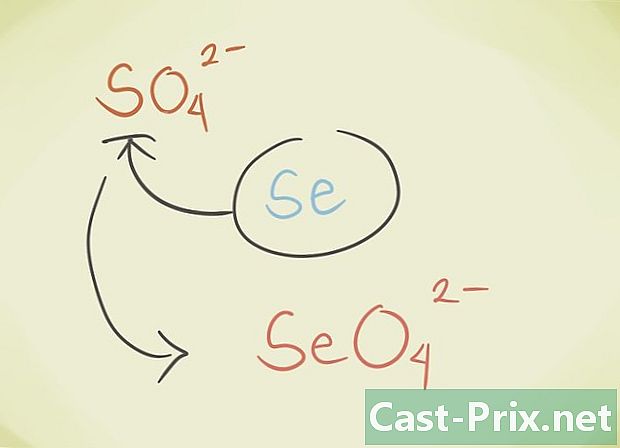
- Voit korvata yhdisteen keskimääräisen latomin toisella atomilla, joka kuuluu samaan jaksoittaiseen ryhmään. Esimerkiksi SO-sulfaatti4 voidaan korvata Selenate SeO4.
- Voit lisätä vetyä yhdisteen ensimmäiseen osaan. Sana "vety" lisätään todellakin yhdisteen nimen alkuun. Tämä vähentää negatiivisen varauksen arvoa yhdellä. Esimerkiksi "karbonaatti" CO3 tulee "vetykarbonaatiksi" HCO3.
-

Muista tavallisimmat dioniryhmät. Seuraavia ryhmiä käytetään useimpien polyatomisten yhdisteiden muodostamiseen. Niiden negatiivisen varauksen kasvavan järjestyksen seurauksena meillä on:- hydroksidi-ionit: OH
- nitraatti-ionit: EI3
- Vetykarbonaatti-ionit: HCO3
- permanganaatti-ionit: MnO4
- karbonaatti-ionit: CO3
- kromaatti-ionit: CrO4
- dikromaatti-ionit: Cr2O7
- sulfaatti-ionit: SO4
- sulfiitti-ionit: SO3
- tiosulfaatti-ionit: S2O3
- Fosfaatti-ionit: PO4
- ammoniumionit: NH4
- Muodosta yhdistelmänimet yllä olevasta luettelosta. Muodosta nimiyhdistelmä mille tahansa ryhmään liittyvälle kohteelle. Jos elementti sijoitetaan ennen ioniryhmää, elementin nimi lisätään yksinkertaisesti yhdistelmän nimen alkuun.
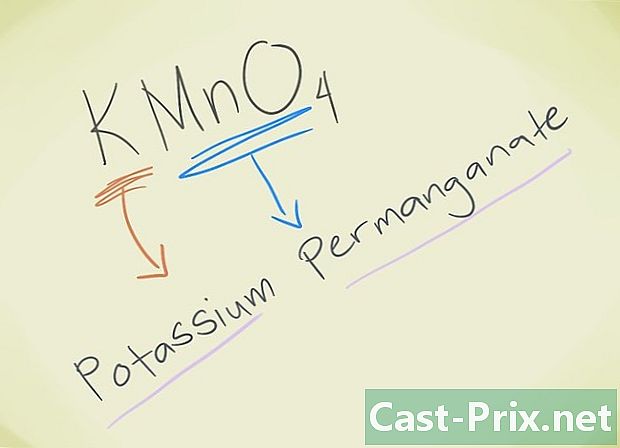
- Esimerkki: KMnO4. Sinun on kyettävä tuntemaan tuo leijona MnO4 vastaa leijonapermanganaattia. K viittaa kaliumiin. Joten yhdistettäsi kutsutaan permanganaattikaliumiksi.
- Esimerkki: NaOH. Olet todennäköisesti ymmärtänyt täällä, että se on OHOH. Na on natrium, joten yhdistettä kutsutaan natriumhydroksidiksi.

- Esimerkki: KMnO4. Sinun on kyettävä tuntemaan tuo leijona MnO4 vastaa leijonapermanganaattia. K viittaa kaliumiin. Joten yhdistettäsi kutsutaan permanganaattikaliumiksi.
Menetelmä 3 kovalenttisten yhdisteiden nimikkeistö
-
Mikä on kovalentti yhdiste? Kovalenttiset yhdisteet johtuvat ainakin kahden ei-metallisen elementin assosioinnista. Yhdisteen nimi määräytyy sitä muodostavien lukudatomien perusteella. Kreikan etuliite tämän nimen vieressä ilmaisee yhdisteessä olevien molekyylien lukumäärän. -
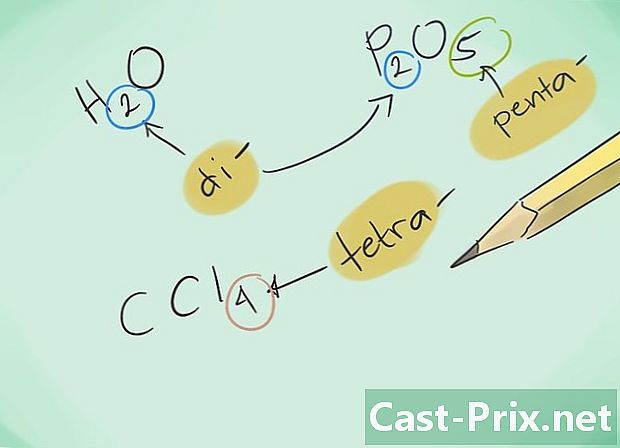
Tutustu etuliitteisiin. Muista seuraavat etuliitteet yhdisteille, joissa on 1 - 8 atomia:- 1 atomi - "mono-"
- 2 atomia - "Di-"
- 3 atomia - "Tri-"
- 4 atomia - "tetra"
- 5 atomia - "Penta-"
- 6 atomia - "Hexa-"
- 7 atomia - "Hepta-"
- 8 atomia - "Okta-"
- Nimeä sitten yhdisteet. Nimeä saatu yhdiste käyttämällä sopivia etuliitteitä. Etuliitteet on oksastettava jokaiselle elementille, jotka muodostavat yhdisteen, jolla on useita atomeja.
- Esimerkki: CO palaa hiilimonoksidiksi, kun taas CO2 tarkoittaa hiilidioksidia.
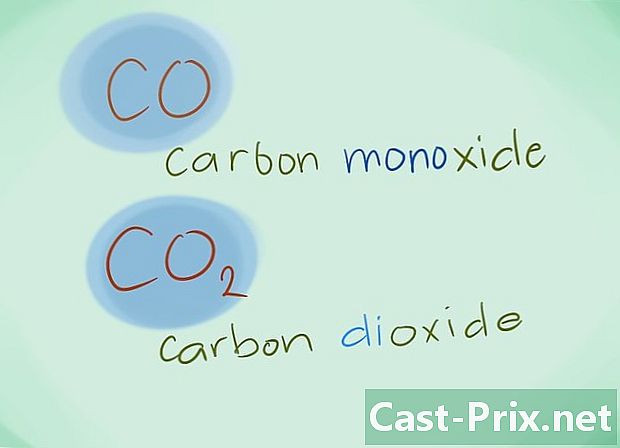
- Esimerkki: N2S3 vastaisi typpipitoista trisulfidia.

- Useimmissa tapauksissa etuliite "mono" voidaan jättää pois; tämä, enemmän kuin mikä tahansa etuliitteen puute, johtaa siihen, että jälkimmäistä on käytettävä. Tätä etuliitettä käytetään edelleen hiilimonoksidin tapauksessa, kun otetaan huomioon, että tämä käyttö juontaa juurensa kemiaan.
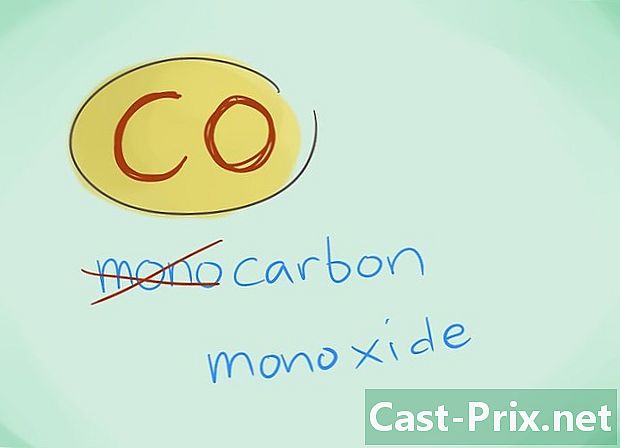
- Esimerkki: CO palaa hiilimonoksidiksi, kun taas CO2 tarkoittaa hiilidioksidia.
- Tietenkin epäilet, että kaikkiin näihin sääntöihin sovelletaan useita poikkeuksia; pidä esimerkiksi tätä kaavaa, CaCl2Odotat näkeväsi sen nimellä "kalsiumdikloridi", joka ei ole. Yhdistesi pitää yksinkertaisesti nimen kalsiumkloridi.
- On myös huomattava, että kaikki tämä ei koske orgaanista kemiaa.
- Tässä olevat yksityiskohtaiset säännöt on tarkoitettu aloittelijoille kemian ja tieteen aloilla. Kehittyneen kemian vaiheen läpi on hyvin erilaisia sääntöjä, kuten muuttuvan valenssin säännöt.

